Das VSEPR-Modell (Valence shell electron pair repulsion model) dient dazu, mit Hilfe von einfachen Prinzipien bestimmen zu können, welche geometrische Form einfache Moleküle besitzen. So lässt sich beispielsweise leicht ermitteln, dass bei dem Molekül Methan (CH4) eine tetraedrische Molekülstruktur vorliegt. Die Molekülstruktur wird bestimmt, indem man sich anschaut, welche geometrische Form die Reste um das Zentralatom aufspannen.
Das VSEPR-Modell (Valence shell electron pair repulsion model) dient dazu, mit Hilfe von einfachen Prinzipien bestimmen zu können, welche geometrische Form einfache Moleküle besitzen. So lässt sich beispielsweise leicht ermitteln, dass bei dem Molekül Methan (CH4) eine tetraedrische Molekülstruktur vorliegt. Die Molekülstruktur wird bestimmt, indem man sich anschaut, welche geometrische Form die Reste um das Zentralatom aufspannen.
 Das VSEPR-Modell findet Anwendung bei kleinen Molekülen, welche ein zentrales Atom besitzen. An diesem zentralen Atom sind dann 2-8 andere Atome gebunden. Deshalb lässt sich das VSEPR-Modell für Moleküle wie H2O, NH3 oder CH4 (hier sind die Zentralatome O, N und C) anwenden, aber nicht für beispielsweise Essigsäure (CH3COOH). Bei Essigsäure liegt nämlich kein Zentralatom mit einatomigen Resten vor.
Das VSEPR-Modell findet Anwendung bei kleinen Molekülen, welche ein zentrales Atom besitzen. An diesem zentralen Atom sind dann 2-8 andere Atome gebunden. Deshalb lässt sich das VSEPR-Modell für Moleküle wie H2O, NH3 oder CH4 (hier sind die Zentralatome O, N und C) anwenden, aber nicht für beispielsweise Essigsäure (CH3COOH). Bei Essigsäure liegt nämlich kein Zentralatom mit einatomigen Resten vor.Es gibt drei einfache Regeln, welche man kennen muss, um die Molekülstruktur nach dem VSEPR-Modell zu bestimmen.
- Bindende und freie Elektronenpaare stoßen sich ab. Dies hat zur Folge, dass alle Reste des Zentralteilchens und dessen freie Elektronenpaare so weit wie möglich voneinander weg sein wollen.
- Freie Elektronenpaare nehmen mehr Platz ein als bindende Elektronenpaare. Freie Elektronenpaare stoßen die Reste nochmal ein kleines Stücken mehr ab. Das hat zur Folge, dass sich alle Winkel des Moleküls ein wenig verzerren. Der Winkel zwischen den freien Elektronenpaaren und den Resten erhöht sich, wohingegen sich der Winkel zwischen den Resten verkleinert.
- Mehrfachbindungen werden wie Einfachbindungen behandelt. Um das Modell einfach zu halten, tut man bei Doppelbindungen so, als wäre es eine Einfachbindung.
Wir schauen uns beide im Detail an, der Unterschied ist aber leicht zu verstehen.
Bei der Pseudostruktur tut man so, als wären die freien Elektronenpaare ganz normale Reste, welche nicht mehr Platz einnehmen als die Atome um das Zentralteilchen herum. Das heißt, wir ignorieren Regel 2.
Bei der Realstruktur wird Regel 2 hingegen berücksichtigt. Hier beachten wir, dass freie Elektronenpaare mehr Platz benötigen als die Reste. Sie drücken die anderen Reste noch ein Stück weiter zusammen. Bei der Bestimmung der Molekülstruktur werden die freien Elektronenpaare aber weggedacht, wenn man die Form des Moleküls an den Resten aufspannt. Dazu aber gleich mehr.
Noch zwei Anmerkungen bevor es weitergeht:
- Keile in der Strukturformel drücken aus, ob der gebundene Rest nach vorne oder nach hinten geht. Sie helfen uns dabei, die Strukturformel dreidimensional nachzuvollziehen.
- Jedes Molekül im VSEPR-Modell gehört zu einem Molekültyp. Der Typ ist einfach eine kurze Notation um darzustellen, um was für eine Art von Molekül es sich handelt, ohne die konkreten Atome benennen zu müssen.
Das Zentralatom wird immer A genannt. Die Reste werden mit X betitelt und die freien Elektronenpaare mit E. Das Molekül CH4 hat also den Typ AX4. Ammoniak hat die Summenformel NH3, aber noch ein freies Elektronenpaar. Folglich gehört es zum Typ AX3E. In der Abbildung findest Du noch ein paar weitere Beispiele. Hier wird auch hoffentlich nochmal klar, was die Pseudostruktur ist: Da wir so tun, als wären die freien Elektronenpaare E dasselbe wie die Reste X, besitzt der Typ AX3E dieselbe Pseudostruktur wie der Typ AX4, AX2E2 und AXE3.
Bestimmen der Pseudostruktur
Wir beginne mit der Pseudostruktur, da sie am einfachsten zu bestimmen ist. Wir gehen anhand des Beispiels H2O durch, wie man hier die Pseudostruktur Schritt für Schritt bestimmt.Das Ziel ist es nun also herauszufinden, welche Struktur H2O im dreidimensionalen Raum aufspannt. Es könnte beispielweise eine tetraedrische, oder eine lineare Struktur sein. Bei der Pseudostruktur behandelt man alle Elektronenpaare wie Reste. Aus E wird also X bei dem Molekültyp.
Zuerst bestimmen wir den Molekültyp. Aus der Summenformel könnte man schließen, dass der Molekültyp AX2 ist. Wir wissen aber, dass der Sauerstoff noch zwei freie Elektronenpaare trägt. Also muss es sich um den Typ AX2E2 handeln. Bei schwierigeren Molekülen weiß man aber nicht immer aus dem Kopf, wie viele freie Elektronenpaare das Zentralteilchen besitzt. Deshalb würde ich immer das folgende Schema abarbeiten, um die Zahl an freien Elektronenpaaren zu ermitteln. Es ist eigentlich dasselbe, wie zur Bestimmung der Lewis-Formel.
- Zeichne das Zentralatom mit allen Valenzelektronen hin. Sauerstoff ist in der sechsten Hauptgruppe (=16. Gruppe) und besitzt folglich sechs Valenzelektronen.
- Verteile jeweils ein Elektron an die Reste. Für jeden Rest X wird ein Elektron für die Einfachbindung zum Rest zur Verfügung gestellt.
- Verbinde die übrig gebliebenen Elektronen zu freien Elektronenpaaren. Es bleiben bei H2O noch vier Elektronen am Sauerstoff übrig. Wir haben also zwei Elektronenpaare am Sauerstoff:
 Wir wissen jetzt, dass H2O den Molekülytpen AX2E2 besitzt. Wir behandeln jetzt aber die freien Elektronenpaare wie Reste, weshalb wir nun so tun, als würde es den Typen AX4 besitzen. Das entspricht einem Molekül, bei welchem das Zentralteilchen vier gleichwertige Reste trägt. Um vier Reste gleichmäßig, also mit maximalem Abstand zueinander, im Raum zu verteilen, muss man sie wie in einem Tetraeder anordnen.
Wir wissen jetzt, dass H2O den Molekülytpen AX2E2 besitzt. Wir behandeln jetzt aber die freien Elektronenpaare wie Reste, weshalb wir nun so tun, als würde es den Typen AX4 besitzen. Das entspricht einem Molekül, bei welchem das Zentralteilchen vier gleichwertige Reste trägt. Um vier Reste gleichmäßig, also mit maximalem Abstand zueinander, im Raum zu verteilen, muss man sie wie in einem Tetraeder anordnen.
 Deshalb besitzt Wasser die Pseudostruktur tetraedrisch! Das Unschöne an der Sache ist allerdings: Woher soll man das denn wissen, wenn man die möglichen Molekülstrukturen nicht kennt?
Wenn man nicht weiß, dass eine tetraedrische Molekülstruktur dafür sorgt, dass die vier Reste den größtmöglichen Abstand zueinander besitzen, kann man die Molekülstruktur auch nicht aus dem Molekültyp bestimmen.
Deshalb besitzt Wasser die Pseudostruktur tetraedrisch! Das Unschöne an der Sache ist allerdings: Woher soll man das denn wissen, wenn man die möglichen Molekülstrukturen nicht kennt?
Wenn man nicht weiß, dass eine tetraedrische Molekülstruktur dafür sorgt, dass die vier Reste den größtmöglichen Abstand zueinander besitzen, kann man die Molekülstruktur auch nicht aus dem Molekültyp bestimmen.Hier hilft leider nur Lernen. Es geht am schnellsten, wenn Du die möglichen Strukturen auswendig lernst. Einfach, damit Du sie kennst und mit ihnen arbeiten kannst. Und dann heißt es: üben, üben, üben.
Im Folgenden findest du eine Tabelle mit allen Pseudostrukturen, die du kennen musst.
| Molekültyp | Beispiel | Pseudostruktur |
|---|---|---|
| AX | H2 | 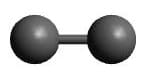 Linear
Linear |
| AX2 | CO2 |  Linear Linear |
| AX3 | BF3 | 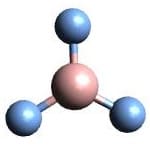 Trigonal Planar Trigonal Planar |
| AX4 | CH4 | 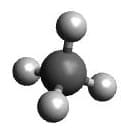 Tetraeder Tetraeder |
| AX5 | PCl5 | 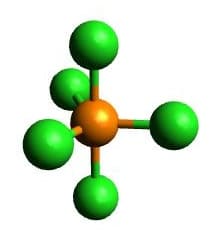 Trigonal Bipyramidal Trigonal Bipyramidal |
| AX6 | SF6 | 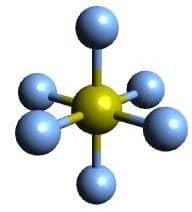 Oktaedrisch Oktaedrisch |
| AX7 | IF7 | 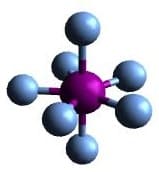 Pentagonal bipyramidal Pentagonal bipyramidal |
| AX8 | IF8– | 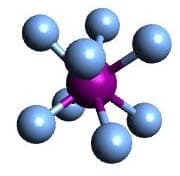 Tetragonal antiprismatisch Tetragonal antiprismatisch |
Bei manchen Strukturen lässt sich ein Muster erkennen: Wenn die Struktur sich aus zwei Wörtern zusammensetzt, beschreibt das erste Wort die Grundfläche und das andere Wort die Gesamterscheinung der Struktur. Für AX5 gilt also: Die Grundfläche besitzt drei Ecken und ist somit trigonal. Da die gesamte Struktur aussieht, als wären zwei Pyramiden aneinandergeklebt an der Grundfläche, ist sie bipyramidal. Zusammen haben wir also eine trigonal bipyramidale Struktur.
- Das Zentralatom besitzt zwei freie Elektronenpaare. Xe hat acht Valenzelektronen: Minus vier Elektronen für die vier Reste ergibt zwei freie Elektronenpaare, die übrig bleiben.
- Molekültyp AX4E2. Wird bei der Pseudostruktur behandelt wie der Typ AX6.
- Oktaedrische Pseudostruktur. Da sechs Reste (X = 6) vorliegen, muss es sich um eine oktaedrische Pseudostruktur handeln.
Bestimmen der Realstruktur
Jetzt wird es leider ein wenig komplizierter. Bei der Realstruktur berücksichtigen wir den erhöhten Platzbedarf der freien Elektronenpaare und müssen uns diese danach wegdenken, wenn wir die Molekülstruktur berücksichtigen wollen.Es gibt den einfachen Fall, dass das untersuchte Molekül gar keine freien Elektronenpaare besitzt. In diesem Fall ist die Realstruktur gleich der Pseudostruktur und du kannst dich der oberen Tabelle bedienen.
In jedem anderen Fall beginnen wir aber wieder damit, den Molekültyp zu bestimmen. Wir nehmen als Beispiel Ammoniak mit der Summenformel NH3.
Ammoniak hat ein freies Elektronenpaar und gehört somit zum Typ AX3E. Die Pseudostruktur wäre tetraedrisch. Die Realstruktur ist aber nicht tetraedrisch, da die oberste Spitze des Tetraeders das Elektronenpaar ist, welches wir uns für die Struktur nun wegdenken. Außerdem werden die drei Reste unten nun ein wenig nach unten gedrückt. Daraus ergibt sich keine tetraedrische, sondern eine trigonal pyramidale Struktur. Da das Zentralteilchen sich nicht mehr in der Mitte des Polyeders befindet, muss es nun berücksichtigt werden, wenn wir die Form aufspannen.
 Als zweites Beispiel besprechen wir XeF4. Xe hat acht Valenzelektronen und es bleiben noch zwei freie Elektronenpaare übrig, da vier Elektronen für die Bindung zu den vier Resten wegfallen. Wir haben also den Typ AX4E2. Es liegt eine oktaedrische Pseudostruktur vor.
Als zweites Beispiel besprechen wir XeF4. Xe hat acht Valenzelektronen und es bleiben noch zwei freie Elektronenpaare übrig, da vier Elektronen für die Bindung zu den vier Resten wegfallen. Wir haben also den Typ AX4E2. Es liegt eine oktaedrische Pseudostruktur vor.
 Ich würde dir immer raten, dir erstmal die Pseudostruktur zu visualisieren und von da aus dann die freien Elektronenpaare zu berücksichtigen.
Ich würde dir immer raten, dir erstmal die Pseudostruktur zu visualisieren und von da aus dann die freien Elektronenpaare zu berücksichtigen.Wir fügen jetzt der Reihe nach die freien Elektronenpaare ein. Das erste packen wir an die obere Spitze. Das zweite freie Elektronenpaar möchte möglichst weit von dem anderen freien Elektronenpaar entfernt sein, da sie beide viel Platz benötigen. Deshalb kommt es genau auf die gegenüberliegende Seite.
 Normalerweise müssen wir zum Visualisieren auch immer berücksichtigen, dass durch die freien Elektronenpaare die anderen Reste ein wenig weggedrückt werden. Da in diesem Fall die Reste von oben und unten gleichermaßen gedrückt werden, bleiben aber alle Reste auf einer Ebene.
Normalerweise müssen wir zum Visualisieren auch immer berücksichtigen, dass durch die freien Elektronenpaare die anderen Reste ein wenig weggedrückt werden. Da in diesem Fall die Reste von oben und unten gleichermaßen gedrückt werden, bleiben aber alle Reste auf einer Ebene.Den Namen dieser Realstruktur kann man sich herleiten, wie bei der Pseudostruktur bereits beschrieben. Die freien Elektronenpaare denken wir uns nun weg. Was bleibt ist eine viereckige Grundfläche. Die Grundfläche ist also quadratisch. Die ganze Struktur sieht flach aus. Sie ist also planar. Folglich ist die Realstruktur von XeF4 quadratisch planar!
In der folgenden Tabelle findest du alle Realstrukturen. Auch sie solltest du die meisten idealerweise mit Karteikarten lernen und dann üben. Du wirst aber schnell ein Muster in der Benennung erkennen.
| Molekültyp | Beispiel | Pseudostruktur | Realstruktur |
|---|---|---|---|
| AXE | CO | 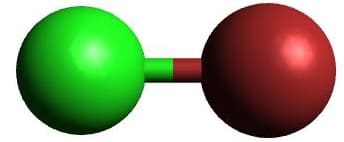 Linear Linear |
 Linear Linear |
| AX2E | SO2 |  Trigonal planar Trigonal planar |
 Gewinkelt Gewinkelt |
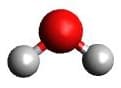
| AX2E2 | H2O |  Tetraedrisch Tetraedrisch |
 Gewinkelt Gewinkelt |
| AX3E | NH3 |  Tetraedrisch Tetraedrisch |
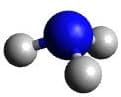 Trigonal pyramidal Trigonal pyramidal |
| AX4E | SF4 |  Trigonal bipyramidal Trigonal bipyramidal |
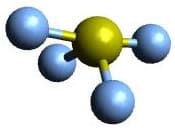 Wippe/ Bisphenoidal Wippe/ Bisphenoidal |
| AX3E2 | ClF3 |  Trigonal bipyramidal Trigonal bipyramidal |
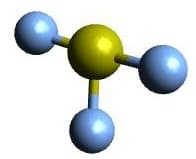 T-förmig T-förmig |
| AX2E3 | XeF2 |  Trigonal bipyramidal Trigonal bipyramidal |
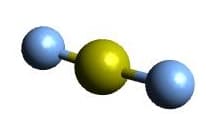 Linear Linear |
| AX5E | ClF5 |  Oktaedrisch Oktaedrisch |
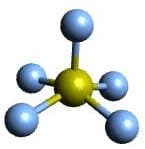 Quadratisch pyramidal Quadratisch pyramidal |
| AX4E2 | XeF4 |  Oktaedrisch Oktaedrisch |
 Quadratisch planar Quadratisch planar |
| AX6E | XeOF5– |  Pentagonal bipyramidal Pentagonal bipyramidal |
 Pentagonal pyramidal Pentagonal pyramidal |
| AX5E2 | XeF5– |  Pentagonal bipyramidal Pentagonal bipyramidal |
 Pentagonal planar Pentagonal planar |
Auf einem Blick...
Das VSEPR-Modell
- Mit dem VSEPR-Modell beschreibt man die räumliche Gestalt kleiner Moleküle
- Alle Reste im Molekül ordnen sich so an, dass sie den maximalen Abstand zu anderen Resten haben
- Freie Elektronenpaare nehmen mehr Platz ein, als die Reste bzw. die bindenden Elektronenpaare
- Bei der Pseudostruktur werden die freien EP wie normale Reste behandelt
- Bei der Realstruktur wird der erhöhte Platzbedarf der freien EP berücksichtigt und die freien EP werden beim Bestimmen der Molekülstruktur dann weggedacht
Referenzen
1. E. Riedel, C. Janiak, in Anorganische Chemie, Vol. 8, Walter de Gruyter GmBH, Berlin, 2011.
Wenn nicht anders angegeben, sind alle Abbildungen selbst angefertigt und urheberrechtlich geschützt.