Inhaltsverzeichnis
 Ringspannung ist ein wichtiges Konzept in der organischen Chemie und vereint viele ihrer Grundprinzipien. In diesem Artikel klären wir von Grund auf, was Ringspannung ist, wo sie relevant ist und was der Unterschied zwischen Baeyer-, Pitzer- und Prelog-Spannung ist.
Ringspannung ist ein wichtiges Konzept in der organischen Chemie und vereint viele ihrer Grundprinzipien. In diesem Artikel klären wir von Grund auf, was Ringspannung ist, wo sie relevant ist und was der Unterschied zwischen Baeyer-, Pitzer- und Prelog-Spannung ist.
Was ist Ringspannung?
Wir schauen uns zunächst die Verbrennung von Propan an. Hierbei reagiert Propan mit Sauerstoff zu 3 CO2 und 4 H2O. Wichtig ist für uns auch, dass dabei Energie in Form von Wärme frei wird. Die Reaktion ist nämlich exotherm. Analog können wir nun auch Butan verbrennen.
Hierbei reagiert Propan mit Sauerstoff zu 3 CO2 und 4 H2O. Wichtig ist für uns auch, dass dabei Energie in Form von Wärme frei wird. Die Reaktion ist nämlich exotherm. Analog können wir nun auch Butan verbrennen.
 Hierbei erhalten wir mehr CO2, mehr Wasser und logischerweise auch mehr Energie pro Molekül, das wir verbrennen. Wir schauen uns nun konkrete Zahlen für die Verbrennungswärme (=Verbrennungsenergie) an.
Hierbei erhalten wir mehr CO2, mehr Wasser und logischerweise auch mehr Energie pro Molekül, das wir verbrennen. Wir schauen uns nun konkrete Zahlen für die Verbrennungswärme (=Verbrennungsenergie) an.
| Alkan | Verbrennungswärme [kJ/mol] | Anzahl CH2-Einheiten | Energiedifferenz [kJ/mol] |
|---|---|---|---|
| Propan | 2220 | 1 | ~660 |
| Butan | 2877 | 2 | |
| Pentan | 3536 | 3 |
Was bedeutet kJ/mol?
Was bedeutet das?
Wir halten fest, dass Propan ähnlich stabil sein muss, wie Butan oder Hexan. Wie sieht das Ganze für cyclische Alkane aus? Wir schauen uns Cyclopropan, Cyclobutan und Cyclopentan nach demselben Prinzip an:
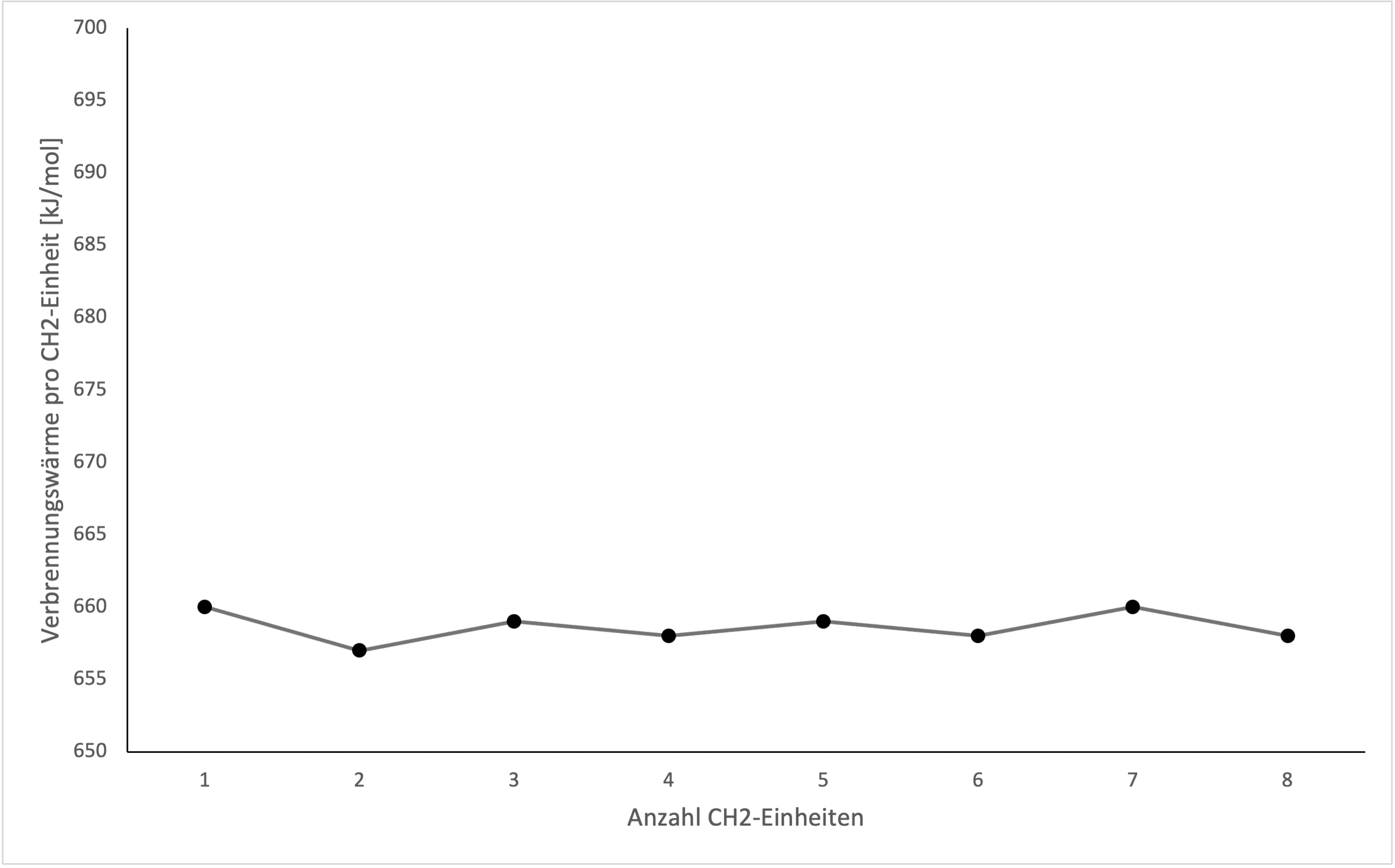
 Die genauen Werte für die Verbrennungswärmen stellen wir wieder in einem Graphen dar:
Die genauen Werte für die Verbrennungswärmen stellen wir wieder in einem Graphen dar:
 Im direkten Vergleich wird klar, dass die cyclischen Alkane sich in ihrer Stabilität stark unterscheiden, von ihren offenkettigen Pendants. Ein paar kurze Interpretationen:
Im direkten Vergleich wird klar, dass die cyclischen Alkane sich in ihrer Stabilität stark unterscheiden, von ihren offenkettigen Pendants. Ein paar kurze Interpretationen:
- Bis auf Cyclohexan, sind alle cyclischen Alkane instabiler (da höhere Verbrennungswärme pro CH2-Einheit), als ihre offenkettigen Partner – Cyclopropan ist weitaus instabiler als Propan.
- Cyclopropan ist das instabilste der hier gezeigten Cycloalkane
- Cyclohexan ist das stabilste cyclische Alkan und ist quasi so stabil wie Hexan
- Die Cycloalkane werden von Cyclopropan zu Cyclohexan immer stabiler – und dann ab Cycloheptan wieder instabiler
Deshalb weisen Cycloalkane in der Regel eine höhere Verbrennungswärme auf, als Alkane, wie im Graph bereits zu sehen war.
Andersherum muss auch zusätzlich Energie aufgewendet werden, um ringgespannte Cycloalkane zu bilden. Du kannst Dir das vorstellen, wie wenn man eine Mausefalle spannt. Die Energie, die wir reinstecken mussten, um die Feder zu spannen, steckt in der Mausefalle drin und wird frei, wenn wir sie wieder entspannen.
Ringspannung ist also erstmal etwas energetisch sehr ungünstiges für Moleküle. Sie kann verschiedene Ursachen haben, welche wir uns jetzt im Detail anschauen wollen.
Baeyer-Spannung
Die Baeyer-Spannung wird auch Winkelspannung genannt und tritt vor allem bei sehr kleinen (n = 3-4), aber auch bei größeren Ringen (n = 7-13) auf. Der Grund hierfür ist, dass vom idealen Bindungswinkel der Kohlenstoffatome abgewichen wird. Was bedeutet das? In Cycloalkanen sind die Kohlenstoffe sp3-hybridisiert und besitzen demnach die Geometrie eines Tetraeders. Der Bindungswinkel, welcher somit vorgegeben ist, beträgt 109,5°. Wenn in einem Cycloalkan dieser Winkel eingehalten werden kann, ist alles super und es liegt keine Winkelspannung vor. Häufig ist dies aber nicht der Fall, und wir sind gezwungen, von diesem Winkel abzuweichen. Dies sorgt für Winkel- und somit Ringspannung und macht das Molekül instabiler. Wir schauen uns mal ein paar Beispiele an.
In Cycloalkanen sind die Kohlenstoffe sp3-hybridisiert und besitzen demnach die Geometrie eines Tetraeders. Der Bindungswinkel, welcher somit vorgegeben ist, beträgt 109,5°. Wenn in einem Cycloalkan dieser Winkel eingehalten werden kann, ist alles super und es liegt keine Winkelspannung vor. Häufig ist dies aber nicht der Fall, und wir sind gezwungen, von diesem Winkel abzuweichen. Dies sorgt für Winkel- und somit Ringspannung und macht das Molekül instabiler. Wir schauen uns mal ein paar Beispiele an.
 Bei Cyclopropan müssen wir ein Dreieck bilden. In einem gleichseitigen Dreieck betragen alle innenliegenden Winkel jeweils 60°. Das heißt, bei Cyclopropan muss auch der C-C-Bindungswinkel 60°C betragen – das ist viel weniger als der ideale Bindungswinkel von 109,5°! Folglich besitzt Cyclopropan eine hohe Baeyer- bzw. Winkelspannung und somit eine hohe Ringspannung. Dies ist eines der Gründe, warum Cyclopropan eine so hohe Verbrennungswärme pro CH2-Einheit aufweist, wie im Graph oben zu sehen.
Bei Cyclopropan müssen wir ein Dreieck bilden. In einem gleichseitigen Dreieck betragen alle innenliegenden Winkel jeweils 60°. Das heißt, bei Cyclopropan muss auch der C-C-Bindungswinkel 60°C betragen – das ist viel weniger als der ideale Bindungswinkel von 109,5°! Folglich besitzt Cyclopropan eine hohe Baeyer- bzw. Winkelspannung und somit eine hohe Ringspannung. Dies ist eines der Gründe, warum Cyclopropan eine so hohe Verbrennungswärme pro CH2-Einheit aufweist, wie im Graph oben zu sehen.
Denkhilfe
Für Neugierige
 Schauen wir uns Cyclobutan an, so erkennen wir, dass der Bindungswinkel zwar etwas größer ist als beim Cyclopropan. Allerdings weicht er immer noch stark vom idealen Bindungswinkel ab. Cyclobutan weist also auch eine hohe Winkelspannung auf, aber nicht so stark wie bei Cyclopropan.
Schauen wir uns Cyclobutan an, so erkennen wir, dass der Bindungswinkel zwar etwas größer ist als beim Cyclopropan. Allerdings weicht er immer noch stark vom idealen Bindungswinkel ab. Cyclobutan weist also auch eine hohe Winkelspannung auf, aber nicht so stark wie bei Cyclopropan.
 Jetzt betrachten wir Cyclohexan. Laut des Graphens oben dürfte hier so gut wie keine Ringspannung vorliegen. Mit einem Winkel von 120° weicht aber auch ein Sechseck vom idealen Bindungswinkel ab! Wie kann Cyclohexan dann so ungespannt/ stabil sein?
Jetzt betrachten wir Cyclohexan. Laut des Graphens oben dürfte hier so gut wie keine Ringspannung vorliegen. Mit einem Winkel von 120° weicht aber auch ein Sechseck vom idealen Bindungswinkel ab! Wie kann Cyclohexan dann so ungespannt/ stabil sein?Die Antwort liegt darin, dass Cyclohexan nicht planar (=flach) ist, wie die Zeichnung suggeriert. Ganz im Gegenteil. Um den idealen Bindungswinkel zu erreichen, nimmt Cyclohexan eine Sesselkonformation ein.
 Die sonst auftretende Winkelspannung zwingt Cyclohexan also in eine dreidimensionale Struktur, in welcher es den idealen Bindungswinkel einnimmt und somit keine Baeyer-Spannung aufweist.
Die sonst auftretende Winkelspannung zwingt Cyclohexan also in eine dreidimensionale Struktur, in welcher es den idealen Bindungswinkel einnimmt und somit keine Baeyer-Spannung aufweist.
Warum machen das nicht alle Moleküle?
Cyclobutan besitzt einen Knick in der Mitte und Cyclopentan sieht eher aus wie ein geöffneter Briefumschlag, als wie ein flaches Fünfeck.
Pitzer-Spannung
Bei der Pitzer-Spannung handelt es sich um eine Torsionsspannung. Um zu klären, was das bedeutet, schauen wir uns Ethan an. Links und rechts sind beides Ethan Moleküle. Sie unterscheiden sich aber in ihrer Konformation. Das heißt, wir haben einfach um die C-C-Bindung gedreht. Hierbei ist die linke Konformation deutlich stabiler als die rechte Konformation, weil sich die H´s nicht so im Weg stehen. Deutlicher wird das in der Newman-Projektion.
Links und rechts sind beides Ethan Moleküle. Sie unterscheiden sich aber in ihrer Konformation. Das heißt, wir haben einfach um die C-C-Bindung gedreht. Hierbei ist die linke Konformation deutlich stabiler als die rechte Konformation, weil sich die H´s nicht so im Weg stehen. Deutlicher wird das in der Newman-Projektion.
 Die linke Anordnung ist die gestaffelte Konformation. Hier sind alle Wasserstoffatome so weit wie möglich voneinander entfernt. Die andere Konformation ist ekliptisch. Hier stehen die H´s direkt hintereinander. Das ist energetisch sehr ungünstig, weil sie sich räumlich zu nahekommen und sich dadurch abstoßen. Wir halten fest:
Die linke Anordnung ist die gestaffelte Konformation. Hier sind alle Wasserstoffatome so weit wie möglich voneinander entfernt. Die andere Konformation ist ekliptisch. Hier stehen die H´s direkt hintereinander. Das ist energetisch sehr ungünstig, weil sie sich räumlich zu nahekommen und sich dadurch abstoßen. Wir halten fest:
 Es fällt auf: Die Wasserstoffe im Cyclopropan sind zwingend ekliptisch angeordnet. Es gibt keine Chance, dass die Wasserstoffe sich aus dem Weg gehen. Das macht Cyclopropan – zusätzlich zur Baeyer-Spannung – instabil.
Es fällt auf: Die Wasserstoffe im Cyclopropan sind zwingend ekliptisch angeordnet. Es gibt keine Chance, dass die Wasserstoffe sich aus dem Weg gehen. Das macht Cyclopropan – zusätzlich zur Baeyer-Spannung – instabil. Die Pitzer-Spannung beschreibt also die Torsionsspannung, die in Cycloalkanen auftreten kann, welche durch ekliptische Anordnungen von Wasserstoffen entsteht. Um noch einen besseren Eindruck zu bekommen, betrachten wir nun Cyclobutan und Cyclopentan.
 Wenn wir Cyclobutan einfach flach hinzeichnen, dann sind alle Wasserstoffe ekliptisch angeordnet. Das führt zu einer sehr hohen Pitzer-Spannung. Was kann das Molekül tun, um diese Spannung wegzunehmen?
Wenn wir Cyclobutan einfach flach hinzeichnen, dann sind alle Wasserstoffe ekliptisch angeordnet. Das führt zu einer sehr hohen Pitzer-Spannung. Was kann das Molekül tun, um diese Spannung wegzunehmen?
 Cyclobutan nimmt hierfür keine flache, sondern eine geknickte, dreidimensionale Gerüststruktur ein. Nun sind die Wasserstoffe nicht mehr so stark ekliptisch angeordnet. Dies erniedrigt die Pitzer-Spannung im Molekül. Ein paar Kommentare hierzu:
Cyclobutan nimmt hierfür keine flache, sondern eine geknickte, dreidimensionale Gerüststruktur ein. Nun sind die Wasserstoffe nicht mehr so stark ekliptisch angeordnet. Dies erniedrigt die Pitzer-Spannung im Molekül. Ein paar Kommentare hierzu:
- Durch den Knick wird zwar die Pitzer-Spannung reduziert, aber die Baeyer-Spannung nimmt ein wenig zu. Das liegt daran, dass die Bindungswinkel noch kleiner werden als 90° und somit noch stärker vom idealen Bindungswinkel abweichen. In Summe gewinnen wir aber trotzdem Energie, weil wir mehr Pitzer-Spannung verlieren, als wir Baeyer-Spannung dazubekommen.
- Da das Molekül dynamisch ist, und sich somit dauerhaft bewegt und verdreht, wird es in Realität nicht die ganze Zeit in dieser energetisch günstigen Konformation vorliegen. Das heißt, wir sind die Pitzer-Spannung nicht vollständig losgeworden, da durch die Bewegungen des Moleküls die Wasserstoffe immer noch häufig in ekliptische Anordnungen gelangen. Cyclobutan ist deshalb immer noch deutlich stärker Pitzer-gespannt als bspw. Cyclohexan!
 Cyclopentan ist auch nicht planar, sondern nimmt eine dreidimensionale Struktur ein, welcher der eines geöffneten Briefumschlags ähnelt. So minimiert es seine Pitzer-Spannung. Hier wird aber auch deutlich, dass es selbst in der energetisch günstigsten Konformation nicht frei von Pitzer-Spannung ist: 4 Wasserstoffe stehen selbst hier ekliptisch zueinander und sorgen für etwas Torsionsspannung:
Cyclopentan ist auch nicht planar, sondern nimmt eine dreidimensionale Struktur ein, welcher der eines geöffneten Briefumschlags ähnelt. So minimiert es seine Pitzer-Spannung. Hier wird aber auch deutlich, dass es selbst in der energetisch günstigsten Konformation nicht frei von Pitzer-Spannung ist: 4 Wasserstoffe stehen selbst hier ekliptisch zueinander und sorgen für etwas Torsionsspannung:
 Die Pitzer-Spannung ist also der Grund, warum kein Cycloalkan – außer Cyclopropan – planar ist, in seiner energetisch günstigsten Konformation.
Die Pitzer-Spannung ist also der Grund, warum kein Cycloalkan – außer Cyclopropan – planar ist, in seiner energetisch günstigsten Konformation.
Prelog-Spannung
Die Prelog-Spannung ist eine sogenannte transannulare Spannung. Transannular heißt hierbei so viel wie „über den Ring hinweg“. Sie tritt bei größeren Ringen (n ≥ 7) auf. Bei der Boot-Konformation von Cyclooctan wird besonders deutlich was das heißt. Hier kommen sich innerhalb des Rings vier Wasserstoffe besonders nahe, was energetisch ungünstig ist. Diese Wasserstoffe sind nicht benachbart, wie es bei der Pitzer-Spannung sonst der Fall ist.
Bei der Boot-Konformation von Cyclooctan wird besonders deutlich was das heißt. Hier kommen sich innerhalb des Rings vier Wasserstoffe besonders nahe, was energetisch ungünstig ist. Diese Wasserstoffe sind nicht benachbart, wie es bei der Pitzer-Spannung sonst der Fall ist.
 Transannulare Spannung tritt also bei großen Ringen auf, da sich hier Wasserstoffe innerhalb des Rings sehr nahekommen können. Dies führt ebenfalls zu Ringspannung. Große Ringe leiden dafür aber nicht so stark unter Bayer-Spannung, da der ideale Bindungswinkel durch die Größe des Rings leichter eingenommen werden kann.
Transannulare Spannung tritt also bei großen Ringen auf, da sich hier Wasserstoffe innerhalb des Rings sehr nahekommen können. Dies führt ebenfalls zu Ringspannung. Große Ringe leiden dafür aber nicht so stark unter Bayer-Spannung, da der ideale Bindungswinkel durch die Größe des Rings leichter eingenommen werden kann.
Auf einem Blick...
Ringspannung
- Ringspannung macht Cycloalkane instabiler, wobei kleien Ringe besonders betroffen sind
- Ringspannung kann durch Baeyer-, Pitzer und/ oder Prelog-Spannung entstehen
- Baeyer-Spannung entsteht durch zu kleine oder zu große Bindungswinkel (Winkelspannung)
- Pitzer-Spannung entsteht durch ekliptische Anordnungen von Wasserstoffen an benachbarten Kohlenstoffzentren (Torsionsspannung)
- Prelog-Spannung entsteht durch transannulare sterische Wechselwirkung von nicht-benachbarten Wasserstoffatomen
Referenzen
1. J.Clayden, N.Greeves, S.Warren, P.Wothers in Organic Chemistry, Vol. 8, Oxford University Press, Oxford, 2008.
Wenn nicht anders angegeben, sind alle Abbildungen selbst angefertigt und urheberrechtlich geschützt.