Charge-Transfer-Komplexe (CT-Komplexe) bilden eine Untergruppe der Elektronen-Donator-Akzeptor-Komplexe.
Da CT-Komplexe intensive Absorptionsbanden zeigen, sind die jeweiligen Verbindungen oft für ihre signifikanten Farben bekannt; jedoch kann
die Absorption wie bei Rutil (TiO2) auch im UV-Bereich liegen.
Das Prinzip beruht auf einen Elektronenübergang von einem Elektronen-Donator zu einem -Akzeptor bzw. vom Höchsten besetzten Molekülorbital (HOMO) in das niedrigste unbesetzte Molekülorbital (LUMO) des Komplexes.
Der Übergang wird durch Lichtabsorption initiiert, wobei die Energie des absorbierten Lichts (hv) der Energiedifferenz ∆E zwischen HOMO & LUMO entspricht. Ein Elektron nimmt also Energie auf, um so einen energetisch angeregten Zustand zu erreichen.
Charge-Transfer-Komplexe (CT-Komplexe) bilden eine Untergruppe der Elektronen-Donator-Akzeptor-Komplexe.
Da CT-Komplexe intensive Absorptionsbanden zeigen, sind die jeweiligen Verbindungen oft für ihre signifikanten Farben bekannt; jedoch kann
die Absorption wie bei Rutil (TiO2) auch im UV-Bereich liegen.
Das Prinzip beruht auf einen Elektronenübergang von einem Elektronen-Donator zu einem -Akzeptor bzw. vom Höchsten besetzten Molekülorbital (HOMO) in das niedrigste unbesetzte Molekülorbital (LUMO) des Komplexes.
Der Übergang wird durch Lichtabsorption initiiert, wobei die Energie des absorbierten Lichts (hv) der Energiedifferenz ∆E zwischen HOMO & LUMO entspricht. Ein Elektron nimmt also Energie auf, um so einen energetisch angeregten Zustand zu erreichen.
Ein Charge-Transfer ist ein Redox-Prozess[1]
Beim Elektronenübergang bleibt das Elektron im selben Molekül und "wechselt" lediglich das Molekülorbital (MO). Wie kann dann also eine Redox-Reaktion stattgefunden haben?Die Antwort lässt sich im reduziertem MO-Digramm eines abstrakten tetraedrischen Komplexes finden:
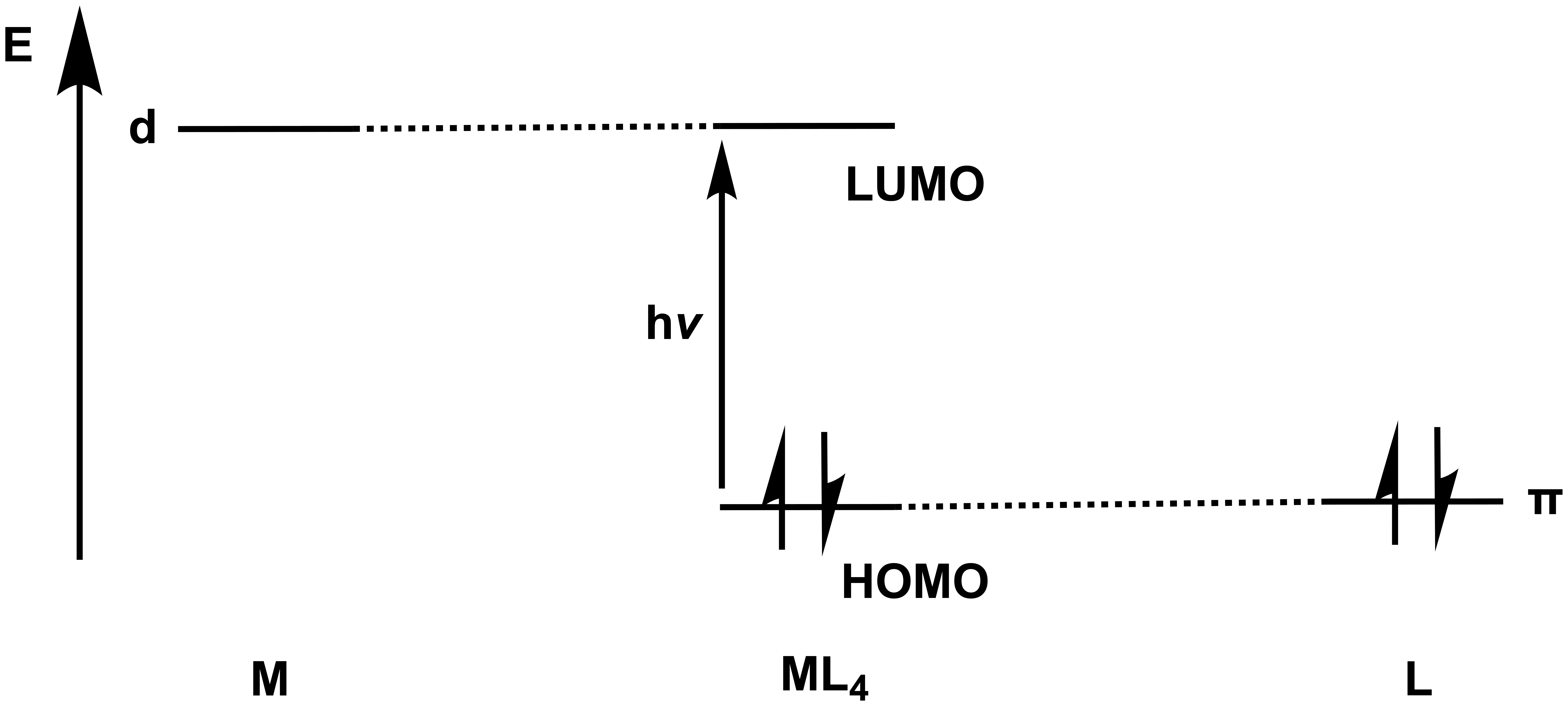
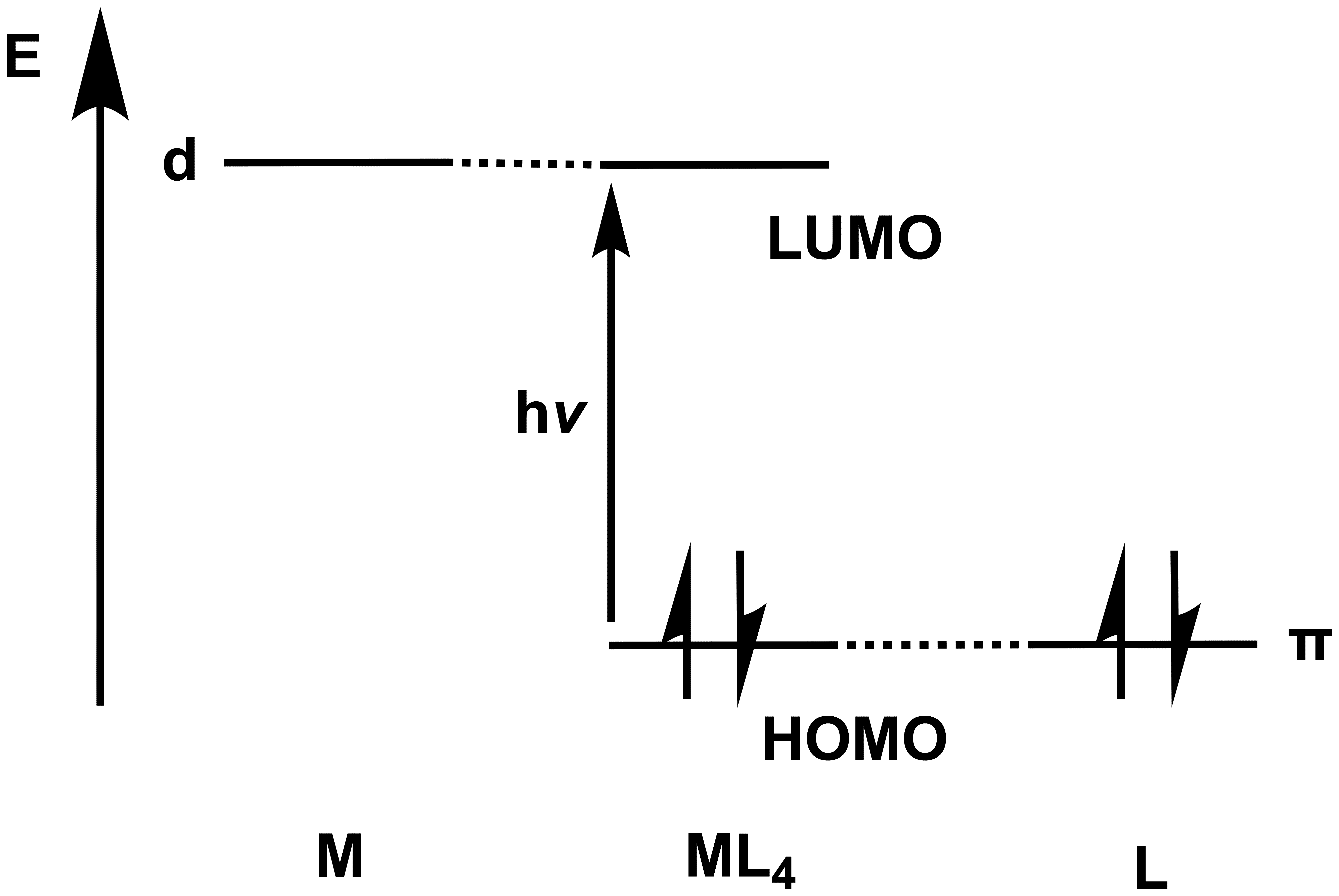
Mit dem d-Orbital des Zentralteilchens M und dem π-orbital des Liganden L. Es sei auch an der Stelle egal, welche Rolle die so gebildeten MO´s spielen bzw. wie die weiteren Molekülorbitale gebildet werden.
Das wichtigere Prinzip ist der Charakter des HOMO´s und des LUMO´s. Das leere d-Orbital des Metalls bildet ein nicht-bindendes MO (hier also das LUMO), welches somit Metall-Charakter besitzt. Das besetzte π-Orbital des Liganden bildet ebenso ein nicht-bindendes MO - da es vom Liganden stammt, hat das HOMO widerrum Liganden-Charakter.
Findet ein Elektronenübergang ins LUMO statt, so befindet sich das Elektron nun in einem Orbital mit Metall-Charakter und wurde aus dem Orbital mit Liganden-Charakter entfernt - Das Metall besitzt nun ein Elektron mehr und wurde somit formal reduziert, während der Ligand ein Elektron abgibt und oxidiert wurde. Eine intramolekulare Redox-Reaktion also!
Dieses Prinzip ist bei allen CT-Komplexen gleich. Nur ist es bei unterschiedlichen Komplexen selbstverständlich möglich, dass die MO´s dort ganz anders aussehn, und das HOMO Metall-Charakter und das LUMO Liganden-Charakter besitzt. In diesem Fall fände ein Elektronenübergang vom Metall zum Liganden statt, jedoch nach dem selben Schema. Die drei wesentlichen CT-Komplex-Klassen, welche hier vorgestellt werden unterscheiden sich also lediglich darin, welcher Part die Rolle des Elektronenakzeptors und welcher die des Elektronendonators spielt.
Ligand-Metall-Charge-Transfer[1]
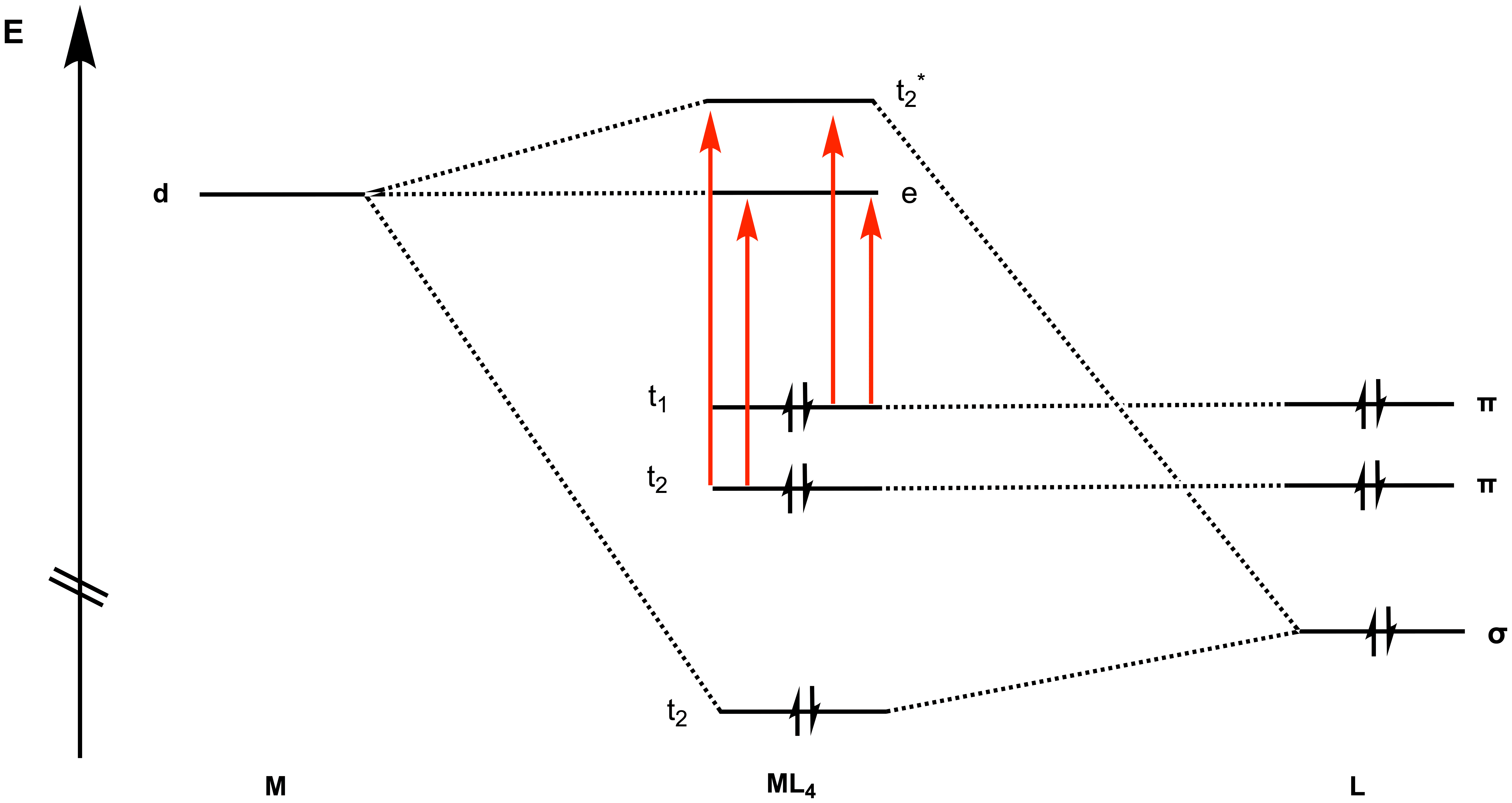
Bei Ligand-Metall-Charge-Transfer-Komplexen (LMCT´s) findet ein Übergang vom Liganden zum Metall statt. Abgebildet ist ein größerer Ausschnitt aus dem MO eines tetraedrischen Komplexes. Die Buchstaben an den Orbitalen beschreiben deren Symmetrie, sind jedoch hier nicht relevant.
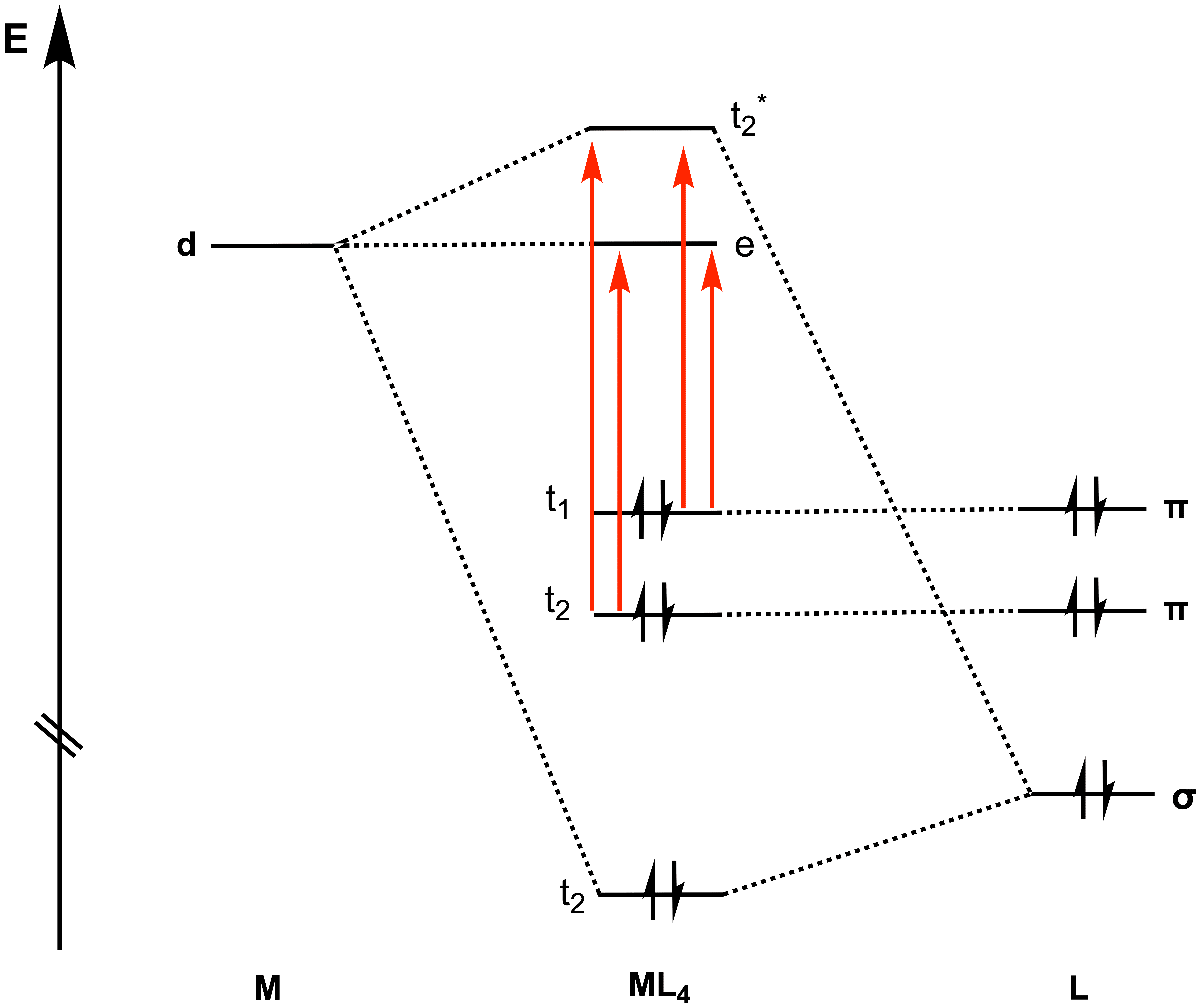
Es soll nur deutlich werden, dass häufig nicht nur ein CT-Übergang möglich ist. Insgesamt sogar vier, wobei alle dem obigen Schema folgen, selbst wenn es auch Übergänge gibt, die nicht zwingend vom HOMO ausgehen und nicht zwingend im LUMO enden. Bei diesen Übergängen liegt jedoch eine größere Energiedifferenz ∆E zwischen den Orbitalen, weshalb wir uns nun auf den HOMO-LUMO-Übergang beschränken, welcher vereinfacht im Folgenden dargestellt ist:
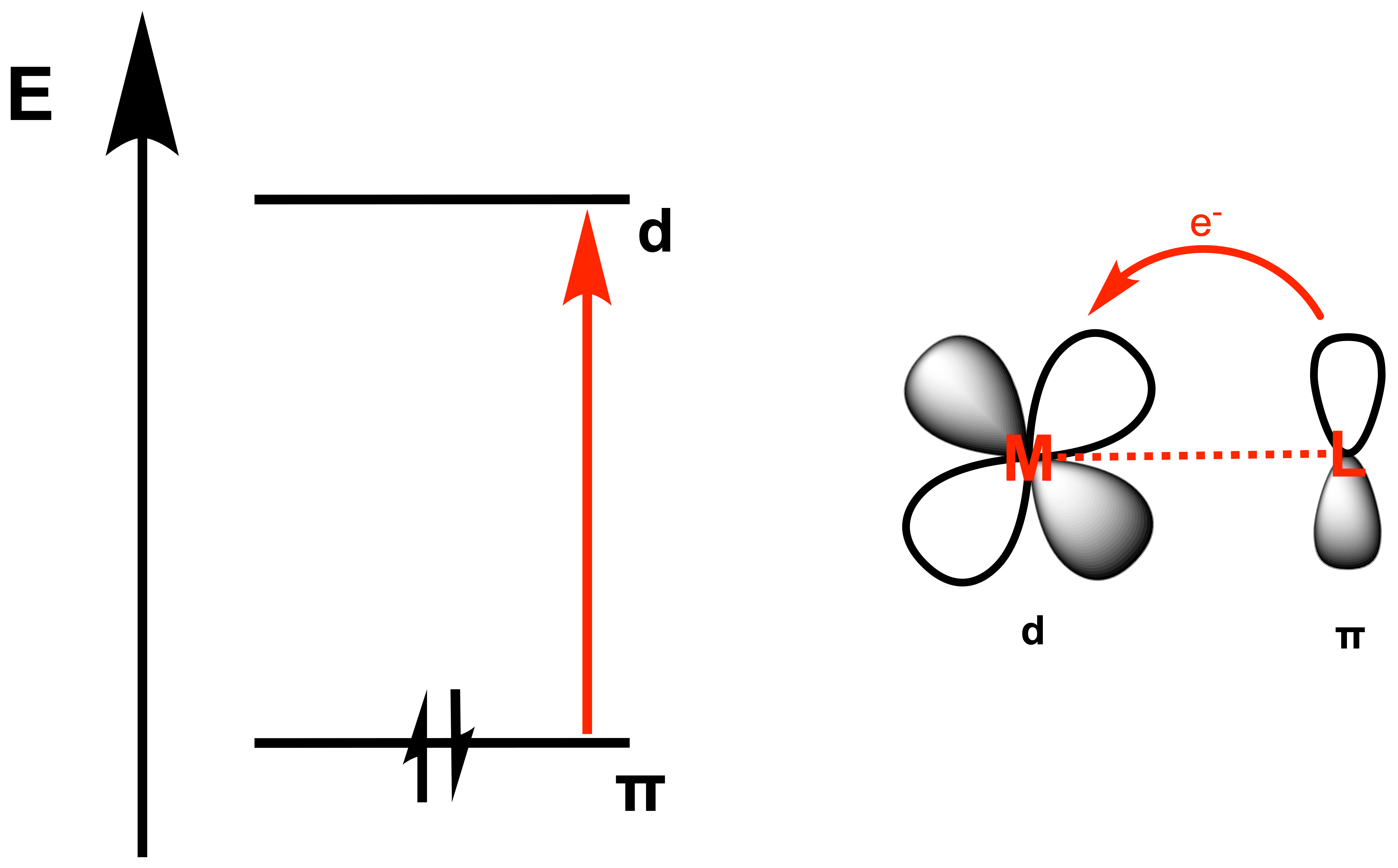
Zur allgemeinen Erklärung des Prinzips reicht diese Darstellung in der Regel aus, da nicht immer genügend Informationen vorliegen, um wie oben das gesamte MO-Diagramm zu zeichnen. Trotzdem sollte im Hinterkopf behalten werden, dass der Vorgang an sich komplexer ist, als in der vereinfachten Darstellung.
Wie lässt sich nun eine Aussage darüber treffen, wie groß ∆E ist? Wenn wir einen CT als Redoxreation verstehen, so lässt sich auch mit der Ionieserungsenergie (IE) und der Elektronenaffinität (AE) argumentieren. Außerdem wissen wir, dass sich ∆E verkleinert, wenn das HOMO möglichst hoch und das LUMO möglichst tief liegt. Die logische Konsequenz ist, dass wir ein Zentralteilchen mit hoher Ionisierungsenergie benötigen, damit das LUMO energetisch tiefliegend ist. Hochgeladene Ionen der Nebengruppenelemente sind hierfür geeignete Kandidaten (Mn(VII), Cr(VI), ...). Für den Liganden gilt, dass er eine möglichst geringe Elektronenaffinität besitzen sollte, da dadurch sein HOMO sehr hoch liegt und er leicht Elektronen abgibt. Ionen der 16. Gruppe (O2-, S2-), aber auch Iodid-Ionen genügen bspw. diesem Kriterium.
Welche Komplexe sind typische LMCT´s?
Tiefgelbe Chromat-Ionen sind ebenfalls LMCT´s; sowie Titan(VI)-Oxid, welches jedoch im UV-Bereich absorbiert und somit farblos erscheint.
Metall-Ligand-Charge-Transfer[2]
Ein MLCT findet bei Komplexen statt, in welchen die Liganden als Akzeptor und das Zentralteilchen als Donor agiert, also genau andersherum wie beim LMCT. Hierfür werden vor allem Liganden mit niedrig liegenden π*-Orbital (LUMO) benötigt, wie z.B. in aromatischen Molekülen. Typische MLCT Liganden sind CO, CN-, Bipyridin (Bipy) und Phenantrolin (Phen). Das Elektron stammt bspw. aus einem der besetzten d-Orbitale des Zentralteilchens. Der Übergang ist im Folgenden vereinfacht ohne detailliertes MO-Diagramm dargestellt.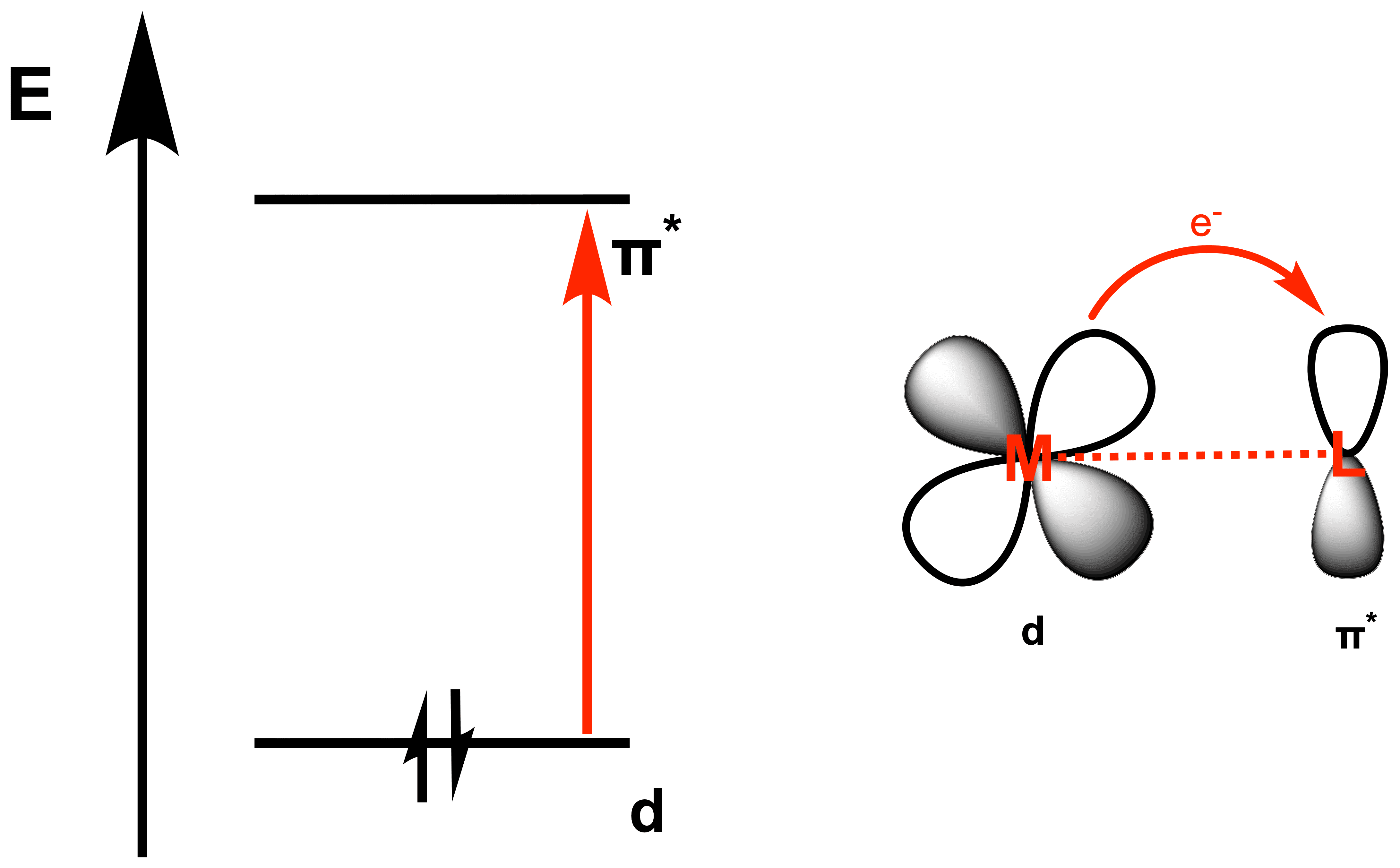 Für eine geringe Energiedifferenz beim Übergang gilt quasi das Gegenteil wie bei den LMCT´s. Hier wird ein Zentralteilchen in niedriger Oxidationsstufe (hohes HOMO, geringe IE) und ein Ligand mit niedrigem π*-Orbital benötigt.
Für eine geringe Energiedifferenz beim Übergang gilt quasi das Gegenteil wie bei den LMCT´s. Hier wird ein Zentralteilchen in niedriger Oxidationsstufe (hohes HOMO, geringe IE) und ein Ligand mit niedrigem π*-Orbital benötigt.
Welcher Komplex ist ein Beispiel für ein MLCT?
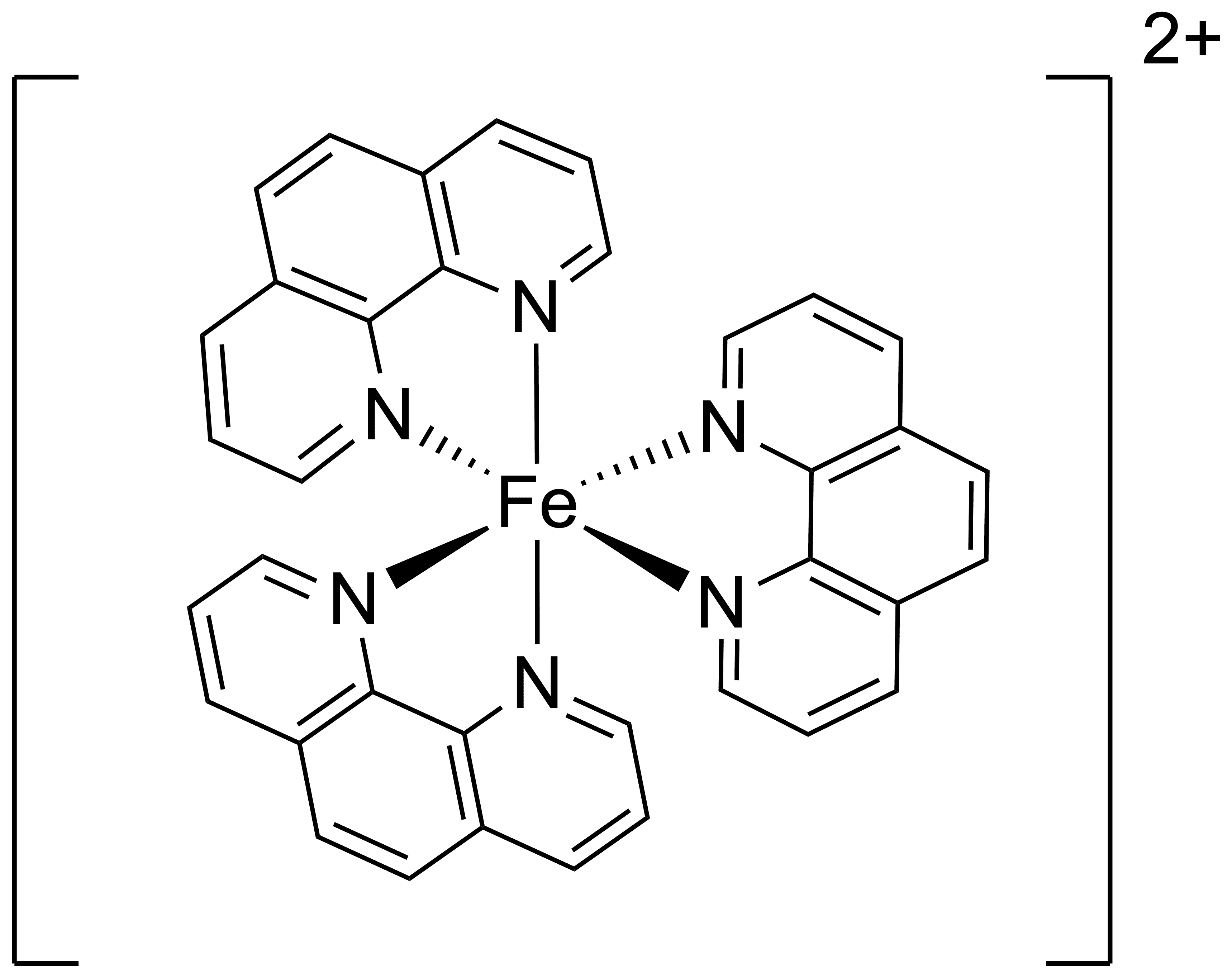
Metall-Metall-Charge-Transfer[2]
MMCT ́s treten hauptsächlich bei mehrkernigen (gemischtvalenten) Komplexen auf, in welchen das Metall in verschiedenen Oxidationsstufen vorliegt. Das bekannteste Beispiel ist vermutlich das Berliner Blau, in welchem ein Redox-Prozess zwischen dem FeII (Donor) und dem FeIII (Akzeptor) stattfindet.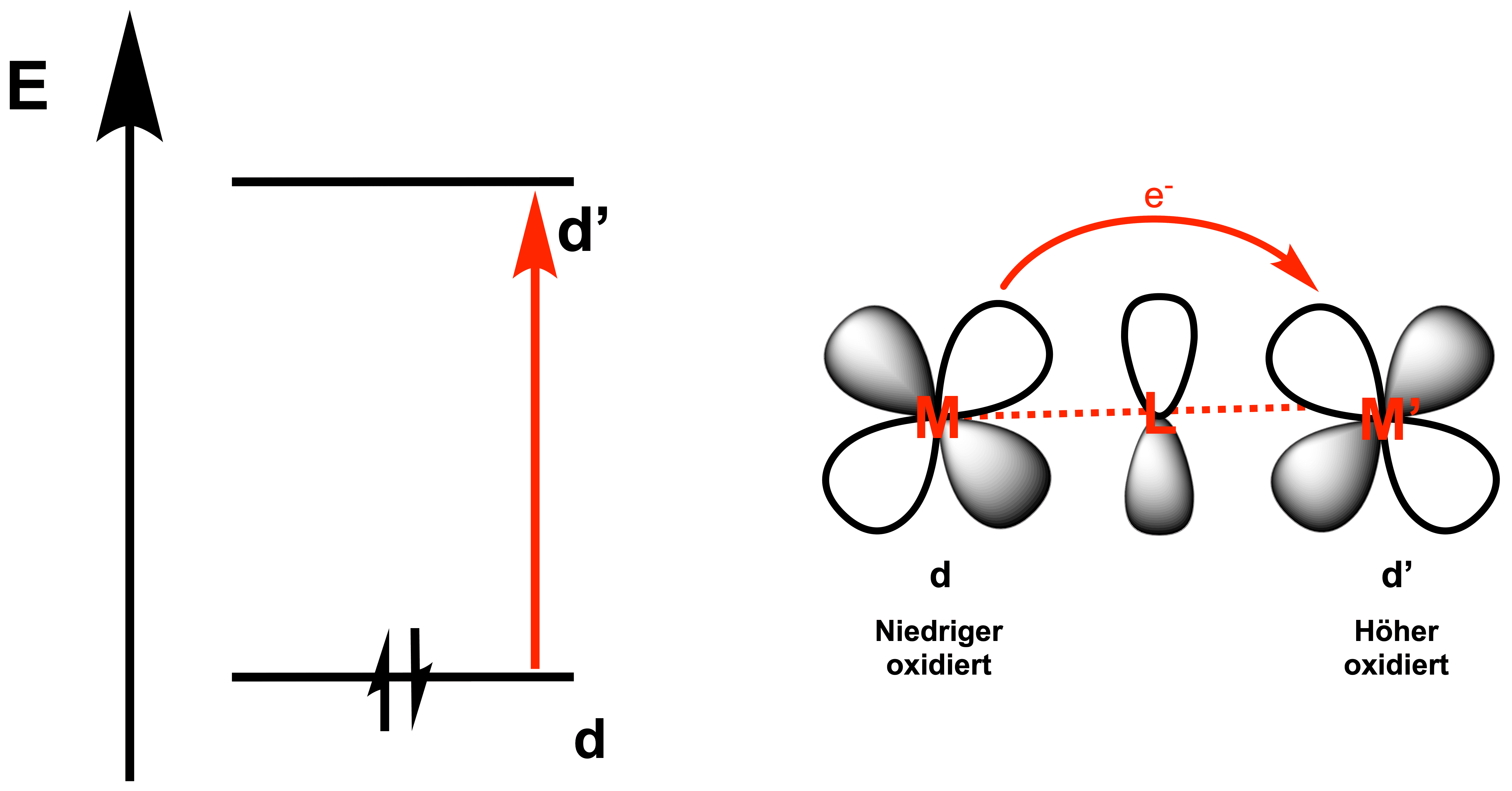

Auf einem Blick...
CT-Komplexe
• Interne Redoxreaktion
• Der Orbitalcharakter ändert sich beim Übergang
• Häufig mehr als ein Übergang möglich
LMCT´s
• Ligand wird oxidiert
• Metall wird reduziert
• Metall sollte hoch oxidiert sein
• Bspw. Oxido-, Thio-, Iodido-Liganden
Referenzen
1. J. Huheey, E. Keiter, R. Keiter in Anorganische Chemie, Vol. 8, de Gruyter, Berlin, 1995.
2. W. Kaim, S. Ernst, S. Kohlmann, Chem. Unserer Zeit 1987, 21, 50-58.
Wenn nicht anders angegeben, sind alle Abbildungen selbst angefertigt.