Was ist ein Atom?
Atome sind die kleinsten Bausteine von Stoffen. Sie können mit anderen Atomen Verbindungen eingehen und Moleküle bilden. Moleküle lassen sich also in Atome auftrennen, Atome bzw. Elemente selbst lassen sich aber nicht in andere Stoffe zerlegen. Jedes Atom gehört zu einem chemischen Element. Zu welchem es gehört, ist von der Anzahl an Protonen im Kern abhängig.
Jedes Atom gehört zu einem chemischen Element. Zu welchem es gehört, ist von der Anzahl an Protonen im Kern abhängig.
Atome sind aus Elementarteilchen aufgebaut und können Elektronen aufnehmen oder abgeben
Atome lassen sich zwar nicht in andere Stoffe aufteilen, sie sind aber selbst aus drei sogenannten Elementarteilchen aufgebaut: Den positiv geladenen Protonen & den neutralen Neutronen, welche den Kern aufbauen, und den negativ geladenen Elektronen, welche sich um den positiv geladenen Kern in der Atomhülle befinden.
Neutronen
Neutronen sind für uns hier unwichtig, da sie nicht maßgeblich über die chemischen Eigenschaften eines Atoms bestimmen. Stell sie dir einfach als „Kleber“ vor, welcher die positiv geladenen Protonen im Kern zusammenhältProtonen
Die Anzahl der Protonen im Kern bestimmt, zu welchem Element das Atom gehört. Die Anzahl der Protonen, über welches ein Atom verfügt, bezeichnet man als Ordnungszahl eines Elements. Das Periodensystem der Elemente ist grade nach diesen Ordnungszahlen sortiert. Befindet sich nur ein Proton im Kern, so handelt es sich bei diesem Atom um das Element Wasserstoff mit der Ordnungszahl 1, wohingegen es sich bei einer Ordnungszahl von sechs um Kohlenstoff handelt. Im Gegensatz zu der Anzahl an Elektronen, ist die Anzahl an Protonen, die ein Atom hat, immer fest. Würde diese Zahl sich ändern, läge auch ein anderes Element mit komplett anderen Eigenschaften vor.
Befindet sich nur ein Proton im Kern, so handelt es sich bei diesem Atom um das Element Wasserstoff mit der Ordnungszahl 1, wohingegen es sich bei einer Ordnungszahl von sechs um Kohlenstoff handelt. Im Gegensatz zu der Anzahl an Elektronen, ist die Anzahl an Protonen, die ein Atom hat, immer fest. Würde diese Zahl sich ändern, läge auch ein anderes Element mit komplett anderen Eigenschaften vor.
Elektronen
Ein Atom verfügt über genauso viele Elektronen wie Protonen und ist somit nach außen hin neutral. Lithium hat mit der Ordnungszahl 3 drei Protonen und somit drei Elektronen. Dies ist aber nur der Fall, wenn Lithium wirklich elementar vorliegt. Lithium ist nämlich auch dazu in der Lage, ein Elektron abzugeben, um die Edelgaskonfiguration zu erlangen. Wenn es dies tut, hat es nur noch zwei Elektronen in der Hülle, aber immer noch drei Protonen im Kern. Folglich ist es nun einfach positiv geladen: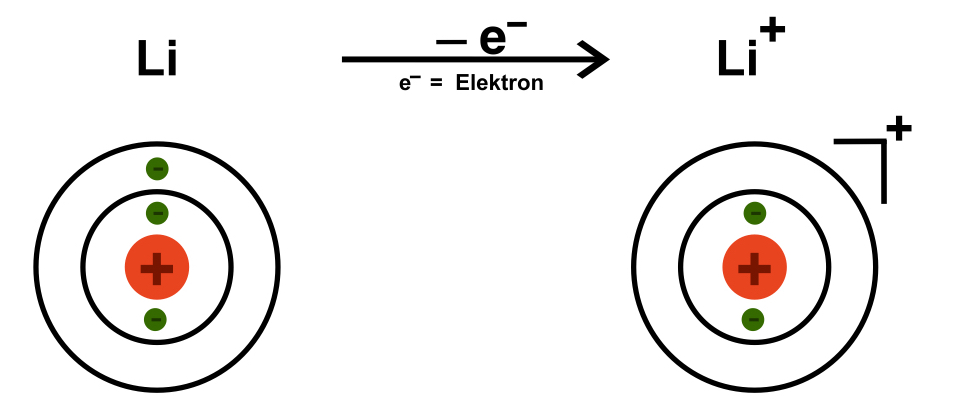 Es entsteht ein sogenanntes Lithium-Ion – genauer ein Lithium-Kation. Ionen sind geladene Teilchen. Ist das Teilchen (also das Atom oder das Molekül) positiv geladen, spricht man von einem Kation. Ist es negativ geladen, so spricht man von einem Anion.
Es entsteht ein sogenanntes Lithium-Ion – genauer ein Lithium-Kation. Ionen sind geladene Teilchen. Ist das Teilchen (also das Atom oder das Molekül) positiv geladen, spricht man von einem Kation. Ist es negativ geladen, so spricht man von einem Anion. Wenn ein Chlor-Atom ein Elektron aufnimmt, so hat es nun 18 Elektronen in der Hülle, aber immer noch 17 Protonen im Kern. Es ist nun nach außen hin negativ geladen – also ein Chlorid-Anion!
Atome können ihre Elektronen auch mit anderen Atomen „teilen“, anstatt sie vollständig abzugeben, und so Moleküle bilden.
Wir halten fest:
- Ein Atom besteht aus einem positiv geladenen Kern, welcher sich aus positiv geladenen Protonen & neutralen Neutronen aufbaut, und aus den negativ geladenen Elektronen in der Elektronenhülle
- Die Anzahl der Protonen eines Atoms ist stets konstant und bestimmt, um welches Element es sich handelt (Anzahl der Protonen = Ordnungszahl). Das PSE ist nach der Ordnungszahl sortiert.
- Die Anzahl an Elektronen ist bei einem Atom gleich der Anzahl an Protonen und sorgt für ein insgesamt neutrales Teilchen. Elektronen können jedoch abgegeben oder aufgenommen werden, wodurch aus dem Atom ein Ion wird.
Das Bohr´sche Atommodell und das Schalenmodell
Wo wir nun wissen, woraus Atome bestehen, wollen wir uns anschauen, wie genau die Struktur der Atomhülle ist. Wir fangen an, mit dem Bohr´schen Atommodell. Es ist zwar längst überholt von dem Orbitalmodell, hat aber immer noch seine Daseinsberechtigung, da sich mit ihm schon viel erklären lässt.Die Elektronen fliegen nach diesem Modell nämlich nicht ungeordnet in der Atomhülle herum, sondern bewegen sich in geordneten Bahnen um den Atomkern. Die Bahnen werden manchmal auch Schalen genannt, auch wenn es streng genommen noch Unterschiede zum Schalenmodell gibt – Beim Schalenmodell spricht man nicht von definierten Kreisbahnen, sondern zwiebelartigen Schichten (Schalen), in welchen sich die Elektronen mit hoher Wahrscheinlichkeit befinden (mehr zu den Wahrscheinlichkeiten beim Orbtialmodell). Aus pragmatischen Gründen werden wir jetzt jedoch immer von Schalen sprechen und das Schalenmodell verwenden.
 Hieraus ergeben sich zwei wichtige Erkenntnisse:
Hieraus ergeben sich zwei wichtige Erkenntnisse:
- Die Elektronen unterscheiden sich voneinander in ihrer Nähe zum Atomkern, da die Schalen unterschiedliche Abstände zum Atomkern besitzen
- Die Schalen werden von unterschiedlich vielen Elektronen besetzt
 Die innerste Schale ist die K-Schale – sie wird als erstes aufgefüllt mit Elektronen. Du kannst dir merken, dass die K-Schale als erstes kommt, indem du dir einfach K = Kern merkst (wenngleich K eigentlich mehr oder weniger willkürlich als Start für die Nummerierung gewählt wurde). Die Schalen danach werden einfach in alphabetischer Reihenfolge benannt: Es folgt die L-, dann die M-, danach die N-Schale usw.
Die innerste Schale ist die K-Schale – sie wird als erstes aufgefüllt mit Elektronen. Du kannst dir merken, dass die K-Schale als erstes kommt, indem du dir einfach K = Kern merkst (wenngleich K eigentlich mehr oder weniger willkürlich als Start für die Nummerierung gewählt wurde). Die Schalen danach werden einfach in alphabetischer Reihenfolge benannt: Es folgt die L-, dann die M-, danach die N-Schale usw. Du kannst dir entweder merken, dass in die erste Schale zwei Elektronen können, in die zweite und dritte acht usw., oder dir einfach das Periodensystem der Elemente anschauen.
 Die Anzahl an Elektronen, welche in eine Schale passen, ist gleich der Anzahl an Elementen/Feldern innerhalb einer Periode. (Erinnerung: Eine Periode ist eine Zeile im Periodensystem). In der ersten Periode wird die K Schale befüllt. Da in der ersten Periode nur H und He als Elemente vorliegen, können wir daraus schließen, dass in die K-Schale nur zwei Elektronen passen.
Die Anzahl an Elektronen, welche in eine Schale passen, ist gleich der Anzahl an Elementen/Feldern innerhalb einer Periode. (Erinnerung: Eine Periode ist eine Zeile im Periodensystem). In der ersten Periode wird die K Schale befüllt. Da in der ersten Periode nur H und He als Elemente vorliegen, können wir daraus schließen, dass in die K-Schale nur zwei Elektronen passen.In die L-Schale passen acht Elektronen. Das kannst du daran erkennen, dass sich acht Elemente in dieser Periode befinden. Und so kannst du das für jede Schale bestimmen. Wie viele Elektronen in jede Schale passen, ist wichtig für die Oktettregel bzw. für die sogenannte Edelgaskonfiguration.
Auf einem Blick...
Atomaufbau
- Atome/ Elemente lassen sich nicht in weitere Stoffe auftrennen
- Atome sind aus Neutronen & Protonen im Kern und Elektronen in der Atomhülle aufgebaut
- Zu welchem Element ein Atom gehört, wird von der Anzahl der Protonen im Kern bestimmt
- Im Grundzustand (elementar) haben Atome genau so viele Elektronen in der Atomhülle, wie Protonen im Kern
- Atome können Elektronen aufnehmen oder abgeben, wobei sie zu den entsprechenden Ionen reagieren
Schalenmodell
- Die Elektronen befinden sich in verschiedenen Schalen, welche unterschiedliche Abstände zum Atomkern besitzen
- Die Schalen kannst du dir wie die Schichten einer Zwiebel vorstellen
- Die Schalen werden alphabetisch betitelt, beginnend mit der K-Schale (Merksatz: K = Kern)
- In jede Schale passen eine definierte Anzahl an Elektronen
- Wie viele Elektronen in jede Schale passen, lässt sich am PSE ablesen
Referenzen
1. E. Riedel, H.-J. Meyer in Allgemeine und anorganische Chemie,
Wenn nicht anders angegeben, sind alle Abbildungen selbst angefertigt.